DURCHFALL, ABGESCHLAGENHEIT UND BAUCHKRÄMPFE KÖNNEN VIELE URSACHEN HABEN – MANCHMAL SIND DARMPARASITEN SCHULD.
Darmparasiten sind Kleinstlebewesen, die den Darm befallen und darin einige Zeit leben. Viele Parasiten kommen hauptsächlich in den Tropen vor. Aufgenommen werden Eier oder Larven über verunreinigte Nahrung oder über die Haut, zum Beispiel beim Barfußlaufen über larvenhaltigen Boden. Giardia lamblia, Cryptosporidium parvum, Entamoeba histolytica und Dientamoeba fragilis gehören zu den wichtigsten Diarrhoe verursachenden Protozoen.
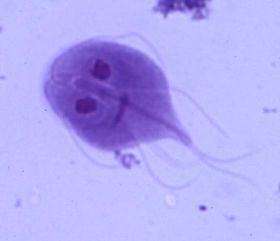 Giardia lamblia
Giardia lamblia
Giardia lamblia (auch G. intestinalis oder G. duodenales genannt) ist einer der häufigsten nicht-viralen Erreger von Durchfallerkrankungen. Laut CDC (Center for Disease Control) sind ca. 2% aller Erwachsenen und 6-8% der Kinder in Industrieländern sowie ca. ein Drittel aller Menschen in Entwicklungsländern mit G. lamblia infiziert.1 Das CDC schätzt, dass jedes Jahr in den USA ca. 77.000 Fälle von Giardiasis (Lambliasis) auftreten.2 Die Infektion erfolgt nach Aufnahme von Zysten aus kontaminiertem Trinkwasser, kontaminierten Lebensmitteln oder auf fäkal-oralem Weg von Person zu Person. Die Inkubationszeit beträgt 1 bis 3 Wochen. Die Giardiasis (Lambliasis) tritt als akute oder chronische Diarrhoe auf, wobei auch asymptomatische Zystenausscheider vorkommen. Symptome einer akuten Infektion sind plötzliches Auftreten einer wässrigen Diarrhoe, Appetitlosigkeit, Übelkeit, Unterleibschmerzen und Gewichtsverlust.1
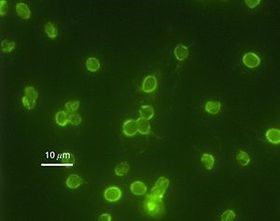 Cryptosporidium parvum
Cryptosporidium parvum
Cryptosporidium parvum ist eine von mehreren Arten der Gattung Cryptosporidium, die häufig Cryptosporidiose beim Menschen verursacht. In den Industriestaaten wurden Cryptosporidien in bis zu 0,2% bei gesunden Individuen und in etwa 2% der Patienten mit Durchfällen nachgewiesen. In Entwicklungsländern liegt die Prävalenz mit bis zu 9% sehr viel höher. Bei HIV infizierten Personen mit Durchfällen wurden bei 14-24% der Fälle Cryptosporidien nachgewiesen, bei asymptomatischen HIV infizierten Personen in bis zu 5%.3,4 Bei einem Ausbruch in Milwaukee (USA) im Jahr 1993 erkrankten mehr als 400.000 Menschen.5 Jedes Jahr treten in den USA schätzungsweise 748.000 Fälle von Cryptosporidiose auf.6 Die Infektion erfolgt überwiegend durch die Aufnahme der Oozysten durch kontaminiertes Wasser und Lebensmittel, aber auch fäkal-orale Schmierinfektionen von Mensch zu Mensch sind möglich. Bei immunkompetenten Menschen manifestiert sich die Cryptosporidiose nach 2-10 Tagen als wässriger Durchfall und kann von Übelkeit, Unterleibschmerzen und Gewichtsverlust begleitet werden. Bei immunsupprimierten Menschen tritt oftmals ein schwerer Krankheitsverlauf auf, der mit einer lebensbedrohlichen chronischen Diarrhoe verbunden ist. 2,5
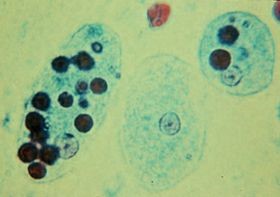
Entamoeba histolytica
Entamoeba histolytica ist die einzige humanpathogene Spezies in der Gattung Entamoeba und Erreger der Amöbiasis. Die Infektion erfolgt fäkal-oral durch die Aufnahme der Zysten durch kontaminiertes Wasser und Lebensmittel, aber auch von Mensch zu Mensch. Während die meisten E. histolytica Infektionen asymptomatisch verlaufen, kommt es in ca. 10% der Fälle zu einer Amöbenkolitis und in seltenen Fällen zu einer extraintestinalen Amöbiasis, überwiegend in der Leber (Amöbenleberabzess). Die klinischen Symptome der intestinalen Amöbiasis sind Bauchschmerzen und starke Durchfälle mit blutigen und schleimigen Stühlen. Die WHO schätzt, dass weltweit etwa 50 Millionen Menschen jährlich an invasiver Amöbiose erkranken, wovon ca. 100.000 versterben.2,7
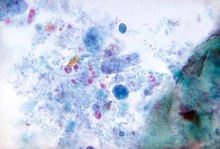 Dientamoeba fragilis
Dientamoeba fragilis
Dientamoeba fragilis ist weltweit verbreitet. Jüngste Studien haben sowohl das pathogene Potential von D. fragilis als auch den Erreger als häufige Ursache einer Gastroenteritis nachgewiesen. Eine Infektion mit D. fragilis kann entweder symptomatisch oder asymptomatisch sein. Die Symptome der Dientamoebiasis sind Bauchschmerzen und Durchfall. Die Prävalenz von D. fragilis variiert von 0,3% bis zu 52% und übertrifft oft die von Giardia lamblia.8,9
Referenzen
- Centers for Disease Control and Prevention 2011. Giardia Epidemiology & Risk Factors, cdc.gov/parasites/giardia/epi.html. Aufgerufen am 10.07.2012.
- Food and Drug Administration (FDA) 2011. Bad Bug Book 2nd Edition;
- Robert Koch Institut 2010. Kryptosporidiose (Cryptosporidium parvum). RKI-Ratgeber für Ärzte 2004. Aufgerufen am 24.07.2012.
- LEE JK, SONG HJ und Jae-Ran YU JR. Prevalence of diarrhea caused by Cryptosporidium parvum in non-HIV patients in Jeollanam-do, Korea . Korean J Parasitol. 2005, 43(3):111-114.
- Leitch GJ und Qing He. Cryptosporidosis - an overview. J Biomed Res. 2012, 25(1): 1-16.
- Scallan E et al. Foodborne Illness Acquired in the United States - Major Pathogens. Emerg Infect Dis. 2011, 17(1): 7-15.
- Fotedar R et al. Laboratory diagnostic techniques for Entamoeba species. Clin Microbiol Rev. 2007, 20(3):511-532.
- Stark D et al. A review of the clinical presentation of dientamoebiasis. Am J Trop Med Hyg. 2010, 82(4):614-9.
- Baratt JLN et al. A review of Dientamoeba fragilis carriage in humans: several reasons why this organism should be considered in the diagnosis of gastrointestinal illness. Gut Microbes. 2011, 2(1):3-12.
Diagnostik
Klassisch erfolgt die Diagnose von G. lamblia, C. parvum, Entamoeba und D. fragilis durch mikroskopische Untersuchung von Stuhlproben, wofür erfahrenes Personal zur Verfügung stehen muss. Die RIDA®GENE Parasitic Stool Panel multiplex real-time PCR ist eine neue und attraktive Alternativmethode zur Untersuchung von Stuhlproben und hat sich als hoch sensitiv und spezifisch für den gleichzeitigen Nachweis der vier wichtigsten Durchfall verursachenden Parasiten (G. lamblia, C. parvum, E. histolytica und D. fragilis) erwiesen.
R-Biopharm bietet folgende Tests an:
Gesamtes R-Biopharm PCR Portfolio
Testprinzip
RIDA®GENE Parasitic Stool Panel ist eine multiplex real-time PCR zum direkten qualitativen Nachweis und zur Differenzierung von Giardia lamblia, Cryptosporidium parvum, Entamoeba histolytica und Dientamoeba fragilis in humanen Stuhlproben. Nach der DNA-Isolierung werden (falls vorhanden) die spezifischen Genfragemente für Giardia lamblia, Cryptosporidium parvum, Entamoeba histolytica und Dientamoeba fragilis (18s-ITS) amplifiziert.
Die amplifizierten Zielsequenzen von Giardia lamblia, Cryptosporidium parvum und Entamoeba histolytica werden mit Hydrolyse-Sonden, die an einem Ende mit dem Quencher und am anderen Ende mit einem Reporter-Fluoreszenzfarbstoff (Fluorophor) markiert sind, nachgewiesen. In Gegenwart einer Zielsequenz hybridisieren die Sonden mit den Amplikons. Während der Extension trennt die Taq-Polymerase den Reporter vom Quencher. Der Reporter emittiert ein Fluoreszenzsignal, das durch die optische Einheit eines real-time PCR-Gerätes detektiert wird. Das Fluoreszenzsignal steigt mit der Menge der gebildeten Amplikons an. Der RIDA®GENE Parasitic Stool Panel Test enthält eine Internal Control DNA (ICD), um die Probenpräparation und/oder eine potentielle PCR Inhibition kontrollieren zu können. Die amplifizierte Zielsequenz von Dientamoeba fragilis wird mittels einer Schmelzpunktanalyse ausgewertet.
Validierte Extraktionsplatformen und RT-PCR Instrumente:
- RIDA Xtract
- Maxwell 16
- NucliSENS easyMAG
- Magna Pure 96
- m2000sp
- m24sp
- QIAcube
- QIAsymphony SP/AS
- KingFisher
- LightCycler 480II
- LightCycler 480z
- Mx3005P
- ABI7500/FAST/Dx
- m2000rt
- CFX96
- SmartCycler
- Rotor-Gene Q

 English
English


